세계 최초 병인성 아밀로이드베타 응집 원리 및 구조 규명
아밀로이드베타 응집 시 역평행성(anti-parallel) 이합체만 인지기능저하 및 신경세포사멸 등 알츠하이머병 유발
평행성(parallel) 이합체는 올리고머/플라크로 응집되어도 인지기능저하에 영향無
아밀로이드베타 역평행성 이합체 표적 신약 개발을 위한 약효평가 플랫폼 개발
항생제 옥시테트라사이클린(Oxytetracycline)과 항암제 수니티닙(Sunitinib)의 아밀로이드베타 역평행성 이합체 선택적 결합에 의한 알츠하이머병 치료 기전 규명
앙게반테 케미(Angewandte Chemie) Hot Paper 선정
알츠하이머병은 현대인의 10대 사망 원인 질환 중 유일하게 예방 및 치료 방법이 없는 질병이다. 현재는 뇌의 시냅스를 과도하게 자극해 일시적으로 증상을 완화해주는 대증적 약물 요법이 쓰이고 있지만 시간이 지날수록 증상이 악화되는 알츠하이머병을 치료하기에는 역부족이다.
연세대학교 약학과 김영수 교수팀은 아밀로이드베타 단백질의 응집체 중 역평행성 이합체(anti-parallel dimer) 구조만이 알츠하이머병을 일으킨다는 점을 세계 최초로 밝히고 이를 선택적으로 표적 및 제거 할 수 있는 약물을 신약재창출 접근법으로 찾아냈다. 연구결과는 세계적으로 권위있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’에 ‘Discovery of chemicals to either clear or indicate amyloid aggregates by targeting memory‐impairing anti‐parallel Aβ dimers’라는 제목으로 게재됐고, 연구 성과의 중요성이 인정돼 Hot Paper로 선정됐다.
바이오젠이 임상3상을 진행 중인 아두카누맙을 비롯해 아밀로이드베타와 타우 응집체를 뇌에서 제거하는 다양한 항체 신약후보물질이 지속적으로 임상시험에 진입했으나 아직까지 확실한 치료효과를 보인 물질은 없다. 연이은 임상 승인 실패로 일각에서는 아밀로이드베타나 타우가 알츠하이머병의 원인이 아닐 수 있다는 의견을 제시하고 있다. 김영수 교수팀은 아밀로이드베타 응집체가 다형성(polymorphism)으로 존재한다는 점과 뇌에 아밀로이드베타 플라크가 많이 쌓여도 치매증상이 없는 사람이 있다는 점에 착안해 알츠하이머병을 유발하는 특정 단백질 구조체가 있을 것이라는 가설을 세웠다. 아밀로이드베타를 무분별하게 제거할 것이 아니라 이 특정 병인성 단백질 구조체만 선택적으로 제거해야 유의미한 약효를 기대할 수 있을 것으로 예상했다.
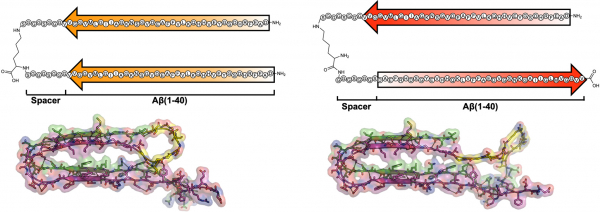
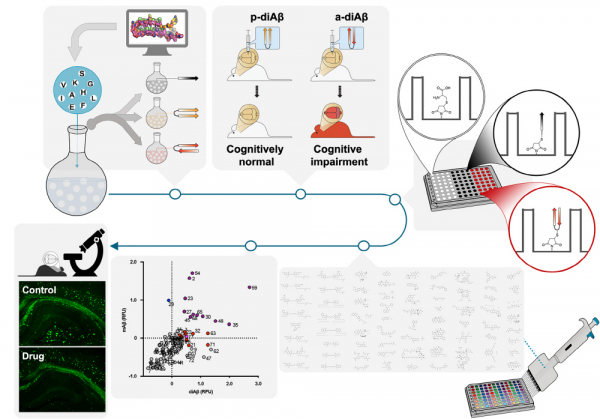
연구팀은 아밀로이드베타 응집 현상의 시작점이며 독성이 매우 높은 이형체(dimer)를 평행성(parallel)과 역평행성(anti-parallel) 두 가지 구조로 합성했다(그림2). 두 가지 이형체 모두 기존에 알려진 아밀로이드베타의 특성과 같이 올리고머와 플라크 형태로 응집했지만, 역평행성 구조의 이형체만이 신경세포 사멸과 생쥐 모델의 인지기능 저하를 유도했다. 학습기억시험(Y-maze, passive avoidance)에서 뇌에 역평행성 이형체 아밀로이드베타를 주입받은 생쥐의 인지기능은 떨어지고 평행성 이형체를 주입받은 생쥐는 정상쥐와 동일한 수준의 인지기능을 보였다.
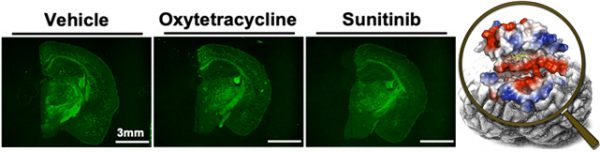
연구팀은 역평행성 이형체 아밀로이드베타를 선택적으로 인지할 수 있는 치료제를 개발하기 위해 약효평가 플랫폼을 개발하고 신약재창출(Drug Repositioning) 연구를 시도했다. 신약재창출이란 이미 시판됐거나 임상개발이 중단된 약물의 새로운 적응증을 찾아내 신약으로 발굴하는 접근법으로 안전성이 검증된 약물을 활용하여 비용절감 및 개발 기간 단축의 장점이 있다. 대표적인 성공사례로는 협심증/고혈압에서 발기부전 치료제로 신약재창출된 미국 화이자의 비아그라가 있다. 김영수 교수팀은 광범위 항생제 옥시테트라사이클린(Oxytetracycline)과 키나아제 억제 기전의 항암제 수니티닙(Sunitinib)이 역평행성 이합체에만 선택적으로 결합하며 알츠하이머병 형질변환 생쥐에 투약했을 때 2주 만에 아밀로이드 올리고머/플라크를 효과적으로 제거하고 시냅스 가소성을 회복시킨다는 결과를 보고했다.
김영수 교수는 “2002년부터 시작한 프로젝트로 19년에 걸친 연구의 성과다. 아밀로이드베타 응집체의 구조가 밝혀져 있지 않아 그동안 알츠하이머병의 합성신약개발에 어려움이 많았다. 이번 연구로 가능성을 보았고 이제 본격적으로 아밀로이드베타 다형체를 연구해 알츠하이머병의 병인구조체를 모두 찾고 그 결과를 바탕으로 신약을 개발할 예정”이라며, “신약재창출 전략은 장점이 많지만 리스크도 있다. 아쉽게도 옥시테트라사이클린과 수니티닙은 특허성의 문제로 약물 개발이 어렵게 됐지만, 다행히 논문에는 공개하지 않은 합성의약품으로 현재 전임상 및 비임상을 진행하고 있다”고 말했다.
본 연구는 한국보건산업진흥원 국가치매극복기술개발사업, 한국연구재단 중점연구소지원사업/이공학개인기초기본연구사업/뇌과학원천기술개발사업, 포스코청암재단 포스코사이언스펠로십의 일환으로 추진됐다.
▶ 기사제보 및 보도자료 press@cdaily.co.kr
- Copyright ⓒ기독일보, 무단전재 및 재배포 금지

























![[워싱턴=AP/뉴시스]도널드 트럼프 미국 행정부가 29일(현지 시간) 한국을 환율관찰대상국으로 재지정했다. 사진은 스콧 베선트 미국 재무장관. 2026.01.30.](https://images.christiandaily.co.kr/data/images/full/141689/ap-29-2026-01-30.jpg?w=318&h=211&l=42&t=53)